Das Medizinprodukterecht-Durchführungsgesetz (MPDG) ist im vollen Umfang in Kraft getreten, daher wird aus dem MPG Beauftragten nun der MPDG Beauftragter. Die umfassenden Anpassungen wirken sich auf das bislang geltende Medizinproduktegesetz und weitere Vorschriften aus. Doch was ändert sich mit dem MPDG? Worauf muss man im medizinischen Alltag achten?
Wir haben die wichtigsten Informationen zusammengestellt.
Was macht ein MPDG-Beauftragter?
Ein MPDG-Beauftragter unterstützt den Betreiber bei der Umsetzung dieser gesetzlichen Vorschriften und trägt damit zur sicheren Anwendung und Betreibung von Medizinprodukten bei. Außerdem übernimmt er die Organisation von verschiedenen Aufgaben wie beispielsweise:
- Einweisung durch den Hersteller
- Funktionsprüfung bei Inbetriebnahme
- Durchführung und Organisation von Anwendereinweisungen
- Dokumentenpflege gemäß MPBetreibV
Der MPDG-Beauftragte ist in Einrichtungen wie Krankenhäusern, der stationären und ambulanten Pflege tätig, sowie im Rettungsdienst und in Arztpraxen. Also grundsätzlich dort, wo Medizinprodukte genutzt werden.
Was sind Medizinprodukte?
Medizinprodukte sind alle Instrumente, Apparate, Vorrichtungen und Software, die für medizinische Zwecke verwendet werden, sei es zur Diagnose, Behandlung oder Überwachung von Patienten. Nach Schätzungen des Bundesgesundheitsministeriums gibt es rund 400.000 verschiedene Medizinprodukte. Beispiele für Medizinprodukte sind Spritzen, Infusionspumpen, Implantate, Herzschrittmacher, Diagnostikgeräte wie Ultraschallgeräte, Magnetresonanztomographen (MRT), CT-Scanner und viele weitere.
Sie können sowohl von medizinischem Fachpersonal als auch von Patienten selbst verwendet werden.
Medizinprodukte können in verschiedene Klassen eingeteilt werden, je nach ihrem Risiko und ihrer Verwendung. Die Klassifizierung reicht von Klasse I, die das geringste Risiko aufweist, bis Klasse III, die das höchste Risiko darstellt.
Die Herstellung, Zulassung und Verwendung von Medizinprodukten sind in vielen Ländern durch spezielle Gesetze und Vorschriften geregelt, um die Sicherheit der Patienten zu gewährleisten.
Medizinprodukte umfassen eine große Bandbreite von medizintechnischen Produkten und Verfahren, die Leben retten, heilen, helfen und die Lebensqualität der Menschen verbessern.
Was ist das MPDG?
Die EU-Richtlinien und Verordnungen bezüglich des Betreibens, der Bereitstellung oder dem Anwenden von Medizinprodukten bieten einen gesetzlichen Rahmen, jedoch sind nationale Vorgaben für die Regelungen und Durchsetzung notwendig.
Diese regeln, welche nationalen Behörden im Allgemeinen zuständig sind oder welche Strafen und Bußgelder bei Missachtung und Übertretung der Richtlinien und Verordnungen durchgeführt werden. Es können auch weitere Änderungen vorgenommen werden, welche jedoch nicht im Widerspruch zu den EU-Verordnungen stehen dürfen und den Wettbewerb nicht negativ beeinflussen.
Diese nationalen Vorgaben regelt das Medizinprodukterecht-Durchführungsgesetz (MPDG), welches als Teil des Medizinprodukte-EU-Anpassungsgesetz – (MPAnpG-EU) eingeführt wurde. Des Weiteren beinhaltet es MPDG Richtlinien zum Gesundheitsschutz aller Beteiligten und regelt den rechtssicheren Betrieb von Medizinprodukten.
Was bleibt nach der Gesetzesänderung gleich und was hat sich geändert?
Abgesehen von der inhaltlichen Änderung des MPG zum MPDG und dem Entfernen einiger Festlegungen umfasst das MPDG jedoch nun ca. 21.000 Wörter. Damit hat es einen deutlich größeren Umfang als das MPG mit ca. 16.000 Wörtern. Neben der weitgehend gleichgebliebenen Struktur wurden die Kapitel zu den Themen Vigilanz, klinische Prüfungen und Übergangsbestimmungen verlängert.
Im MPDG wurden beispielsweise die Freiheitsstrafen auf bis zu 10 Jahren erhöht und präziser aufgenommen. Diese gilt nun auch denjenigen, die gefälschte bzw. nicht registrierte Produkte auf dem Markt verkaufen. Ebenfalls kann die Höhe dieser Freiheitsstrafe auch für gewerbsmäßige oder bandenmäßige Vergehen gelten. Gleiches gilt für das Aufführen irreführender Angaben bezüglich des Produktes. Trotz einer Erweiterung des Bußgeldkataloges im MPDG, bleibt es bei max. 30.000€.
Eine interessante Änderung stellt die Entfernung des Sicherheitsbeauftragten dar. Das Gesetz fordert, dass Sicherheitskorrekturmaßnahmen vom Hersteller mitgeteilt werden müssen, jedoch nicht von einer speziellen Person wie dem Sicherheitsbeauftragten. Eine weitere Änderung ist die Entfernung des DIMDI, sodass nun das BfArM als wesentliche Behörde genannt wird. Betroffen ist hierbei besonders das „Deutsche Medizinprodukteinformations- und Datenbanksystem“ nach §86.
Unser Seminar „MPDG Beauftragter“ bildet Sie hervorragend aus!
In unserem Seminar „Ausbildung zum MPDG Beauftragten“ ehemals MPG Beauftragter erhalten Sie das notwendige Fachwissen kombiniert mit praxisorientiertem Unterricht und dem entsprechenden Know-how, um die erlernte Theorie in der Praxis umzusetzen. Dieses Seminar wurde an die aktuellen gesetzlichen Änderungen gemäß §83 Medizinprodukterecht-Durchführungsgesetz angepasst.
Auf Wunsch können wir gerne an Ihrem Wunschtag eine eigene Schulung in Ihrem Unternehmen durchführen und die Inhalte auf Ihre unternehmensspezifischen Besonderheiten anpassen. Nehmen Sie kostenlos und unverbindlich Kontakt zu uns auf.
Wenn Sie die Ausbildung für zukünftige Sicherheitsbeauftragte lieber zu Hause absolvieren möchten, können Sie es als Onlineseminar buchen.
Zum Schluss ein
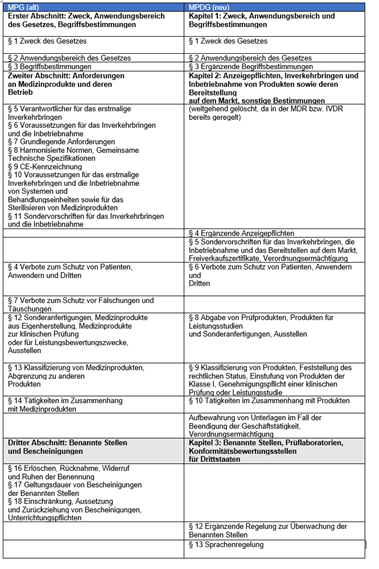
Vergleich von MPG und MPDG
Die folgende Tabelle stellt die Kapitel / Abschnitte und Paragrafen des Medizinproduktegesetzes (MPG) und des Medizinprodukte-Durchführungsgesetzes gegenüber. Das hilft dabei, die Änderungen schneller zu identifizieren.